Teste anticorpi IgG si IgM
Pret 170 RON
Testele serologice pot infirma sau confirma prezenta anterioara a infectiei. Costul pentru anticorpii de tip IgG si IgM este de 170 de ron
- CUM SE RECOLTEAZA – este nevoie de o simpla proba de sange pentru a te testa
- IN CAT TIMP AI REZULTATUL – daca recoltarea este pana la ora 15.00 rezultatele sunt in aceeasi zi; pentru recoltarea de sambata rezultatele sunt disponibile luni dimineata
- CINE SE POATE TESTA – testele sunt disponibile tuturor pacientilor care isi doresc sa se testeze
- CAND TE POTI PROGRAMA – poti sa te prezinti la clinica, fara programare, de luni pana vineri intre orele 07:00 si 20:00 iar sambata intre orele 08.00 si 11.30
SARS-CoV-2 (coronavirusul sindromului respirator acut sever 2) – ARN: Anticorpi IgG
Coronavirusurile (CoVs) sunt virusuri ARN aparținând ordinului Nidovirales, familia Coronaviridae, subfamilia Orthocoronavirinae, care infectează omul și o varietate largă de animale (păsări și mamifere)1. Denumirea acestora provine de la aspectul virionilor în microscopia electronică, ce se remarcă prin prezența unor spiculi proeminenți, de natură glicoproteică, dispuși sub formă de coroană la suprafața particulelor virale. Spiculii au rolul de a se lega de anumiți receptori celulari, favorizând infecția celulelor receptive2.
CoVs sunt clasificate în patru genuri: Alfa-, Beta-, Deltași Gammacoronavirus. Numeroase CoVs au fost detectate la lilieci care ar deține un rol crucial în evoluția acestor virusuri, în special a genurilor alfa și beta-CoVs. Și alte specii de animale pot servi drept gazdă pentru CoVs și rezervor pentru răspândirea la om1. Până în prezent sunt cunoscute 7 subtipuri de coronavirusuri responsabile de infecții în populația umană. În timp ce alfa-CoV determină infecții ușoare/moderate sau asimptomatice, beta-CoV pot produce afectări severe ale tractului respirator, cu potențial letal3. Cele trei beta-Covs zoonotice care au traversat bariera de specie și au cauzat pneumonie fatală la om în secolul 21 sunt: coronavirusul sindromului respirator acut sever (SARS-CoV) responsabil de epidemia SARS declanșată în anul 2002 în provincia Guangdong din China, coronavirusul sindromului respirator din Orientul Mijlociu (MERS-CoV) care a determinat epidemia de infecție respiratorie izbucnită în 2012 în Peninsula Arabică și noul CoV, denumit inițial 2019-nCoV și ulterior SARS-CoV-2, descoperit în decembrie 2019 în Wuhan, provincia Hubei din China, secvențiat și izolat în ianuarie 2020, care a cauzat pandemia actuală de pneumonie atipică4. SARS- CoV-2 aparține genului Betacoronavirus, subgenul Sarbecovirus, ca și SARS-CoV cu care este strâns înrudit1.
Genomul SARS-CoV-2 este constituit dintr-o singură moleculă de ARN monocatenar, cu polaritate pozitivă, dimensiune de aproximativ 30 kb, care prezintă secvențe nucleotidice identice cu SARS-CoV în procent de 79.5%. Genomul conține la capătul 5’ două cadre deschise de citire (open reading frames, ORF), ORF1a și ORF1b, care codifică 16 proteine non-structurale (de exemplu, ARN polimeraza ARN- dependentă, RdRp). La capătul 3’ al genomului se găsesc genele care codifică 4 proteine structural majore: glicoproteina S (proteina structurală a spiculilor), proteina E de înveliș, proteina M de membrană și proteina N a nucleocapsidei. Genomul ARN și proteina N formează o nucleocapsidă cu simetrie helicoidală, înconjurată de învelișul extern. ARN-ul este infecțios, servind atât ca genom, cât și ca ARNm viral5,6. Glicoproteina S SARS-CoV-2 permite virusului să pătrundă în celulele gazdă, utilizând enzima 2 de conversie a angiotensinei (angiotensin convertaza 2, ACE2,) ca receptor de intrare, față de care prezintă o afinitate mult mai mare, comparativ cu glicoproteina S SARS-CoV7. ACE2, similară ca structură cu ACE, constituie un factor reglator negativ al sistemului renină-angiotensină-aldosteron8. ACE2 este o proteină membranară integrală de tip I, care este exprimată și devine activă în mai multe tipuri de celule, cum ar fi celulele epiteliale alveolare, enterocitele și celulele endoteliale din rinichi și cord. Celulele epiteliale alveolare și enterocitele reprezintă ținte pentru SARS-CoV9. Deoarece glicoproteina S este expusă la suprafața virionului și mediază pătrunderea în celula gazdă aceasta devine ținta principală a anticorpilor
neutralizanți produși de organism în cursul infecției și reprezintă un element cheie pentru stabilirea strategiilor terapeutice, inclusiv elaborarea unui vaccin4.
Din punct de vedere clinic, SARS-CoV-2 determină o infecție respiratorie denumită COVID-19 (Coronavirus infectious disease – 2019). Timpul dintre expunerea inițială la virus și debutul simptomelor (perioada de incubație) este de 2-14 zile în 95% din cazuri, cu o medie de 5-6 zile, ceea ce indică că este necesară o perioadă de carantină de minum 14 zile a contacților10.
Boala este caracterizată prin simptomatologie predominant respiratorie: febră, tuse seacă, dispnee de severitate variabilă si poate evolua către pneumonie bilaterală interstițială, insuficiență respiratorie sau detresă respiratorie acută (ARDS) care este principala cauză de mortalitate. Persoanele cu vârstă peste 60 de ani, precum și cele cu comorbidități (cum ar fi, hipertensiune arterială, diabet zaharat, boală cronică de rinichi) prezintă un risc mai mare de boală severă. Există și cazuri cu manifestări gastrointenstinale (mai ales diaree), iar la unii pacienți (în special la cei tineri) au fost semnalate hipo/anosmie (pierderea mirosului) și hipo/disgeuzie (pierderea gustului) ca simptome precoce11. Fiziopatologia ARDS indus de SARS-CoV-2 este similară cu cea a pneumoniei comunitare severe cauzată de alte virusuri sau bacterii. Producția excesivă de citokine proinflamatorii (factorul de necroză tumorală alfa, interleukin 6 și interleukina 1 beta), descrisă ca o “furtună de citokine” se asociază cu un risc crescut de hiperpermeabilitate vasculară și insuficiență multiplă de organ, cu o rată mare de mortalitate12.
Diagnosticul de laborator al infectiei cu COVID-19 poate urma două căi:
- evidențierea virusului prin tehnici de amplificare a materialului genetic viral (teste RT-PCR)
- detecția anticorpilor specifici – care reprezintă răspunsul imun al organismului la virus.
Testele serologice de detecţie a anticorpilor specifici
Aceste teste pot detecta în probe de sânge anticorpii de tip IgM și IgG produși de organismul uman ca răspuns la infecția SARS-CoV-2.
Anticorpii detectați prin teste serologice indică faptul că o persoană a venit în contact cu SARS-CoV-2, indiferent dacă aceasta prezenta simptome specifice infecției sau a fost asimptomatică11.
Un studiu recent privind răspunsul imun umoral într-un lot de 285 pacienți cu infecție SARS-CoV-2 confirmată virusologic a arătat că în decurs de 19 zile de la debutul simptomelor toți pacienții au prezentat un rezultat pozitiv la testarea anticorpilor IgG. Seroconversia IgM sau IgG s-a produs simultan sau secvențial, iar titrurile anticorpilor au atins un nivel de platou în decurs de 6 zile de la momentul seroconversiei. Interesant, testarea serologică suplimentară a 164 contacți ai pacienților cu COVID-19 a condus la identificarea unui procent mic de persoane (4.3%) cu rezultate RT-PCR negative, la care au fost detectați anticorpi IgG sau IgM specifici virusului, sugerând faptul că testele serologice ar putea fi utile în monitorizarea infecțiilor asimptomatice la contacți13. Intr-un studiu similar efectuat pe 173 pacienți cu COVID-19 au fost determinați prin metoda ELISA anticorpii totali cu ajutorul unor antigene recombinante ce conțin domeniul de legare a receptorului din glicoproteina S SARS-CoV-2, anticorpii IgG cu folosirea unei nucleoproteine recombinante și anticorpii IgM printr-o tehnică de captură. Pentru anticorpii totali, IgM și IgG s-a obținut o rată de seroconversie pe perioada spitalizării de 93.1%, 82.7% și respectiv 64.7%, cu o valoare mediană a intervalului până la momentul seroconversiei de 11, 12 și respectiv 14 zile. Combinarea RT-PCR cu diagnosticul serologic a îmbunătățit semnificativ sensibilitatea pentru diagnosticul COVID-19, chiar și în prima săptămână de boală. În plus, un titru mai mare de anticorpi a fost asociat cu un prognostic clinic mai sever14.
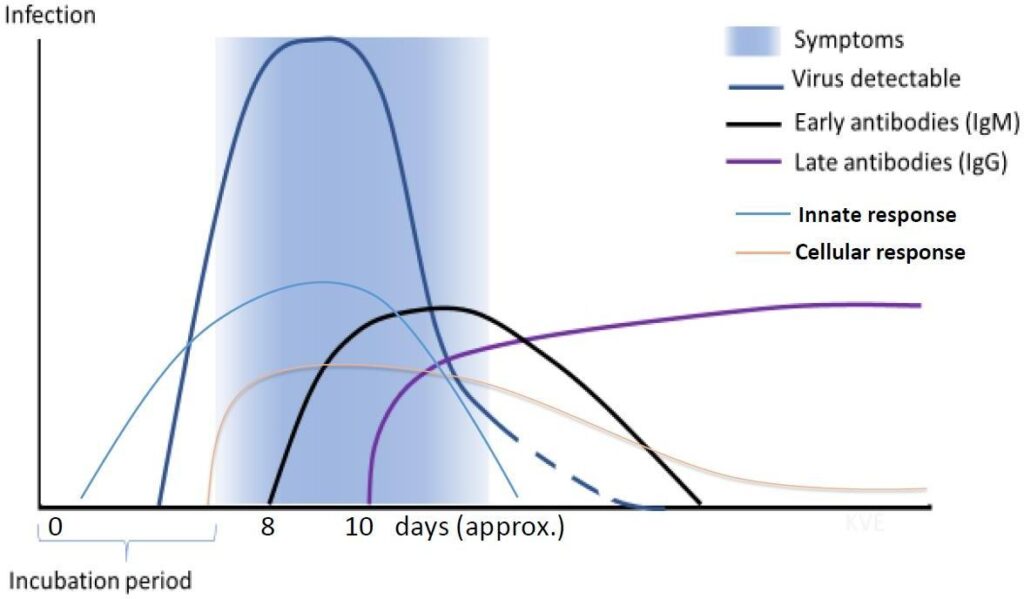
Fig. 1 Preluat https://www.who.int/docs/default-source/coronaviruse/risk-comms-updates/update-24- immuniy-n-clinical-manifestations.pdf?sfvrsn=7c84a6bf_4
Prezența anticorpilor specifici de tip IgM sau titrul de anticorpi specifici tip IgG din faza de covalescență de ≥4 ori mai mare comparativ cu titrul identificat în faza acută pot fi utilizate drept criteriu de diagnostic pentru pacienții suspectați de infecție SARS-CoV-2 cu rezultate negative la testeleRT-PCR. Detecția anticorpilor specifici anti SARS-CoV-2 de tip IgM va permite evidențierea infecțiilor acute, însă cu un interval timp de latență(minim 7 zile post-infecție), față de detecția virusului prin teste RT-PCR. Pe de altă parte, testele IgM pozitive ar trebui confirmate cu testele RT-PCR deoarece un test IgM pozitiv poate apărea și la persoane vindecate, ceea ce limitează foarte mult utilitatea acestei metode pentru diagnosticul infecției și reducerea transmiterii. Deoarece anticorpii IgM s-ar putea să nu se dezvolte precoce sau deloc la pacienții infectați, acest tip de test de anticorpi nu este utilizat pentru a exclude SARS-CoV-2 la un individ.
Prezența anticorpilor de tip IgG nu exclude pacienții cu infecții active, care pot fi încă contagioși. Un rezultat negativ nu exclude prezența virusului–pacienții suspecți de COVID-19 trebuie testați ulterior prin metoda PCR. Înlocuirea testelor de diagnostic molecular cu teste de detecție a anticorpilor nu este recomandată, deoarece un test negativ poate induce o falsă senzație de siguranță pacienților infectați din cauza apariției tardive a seroconversiei11.
Studiile publicate recent arata ca exista o corelație pozitivă puternică între titrul de anticorpi după două săptămâni de la debutul simptomelor și severitatea clinică. Titruri ridicate de anticorpi SARS-CoV-2 ar putea fi un factor de risc important pentru boala critică, aditional fata de factorii de risc stabiliți anterior: vârstă, sex și afectiuni cronice asociate1.
Conform protocolului Organizației Mondiale a Sănătății (OMS) de diagnostic al infecției SARS-CoV-2 elaborat și publicat pe data de 2 martie 2020, studiile serologice pot fi utile în investigarea pandemiei actuale și în evaluarea ratei de atac sau a extinderii acesteia. În situațiile în care testele de amplificare a acizilor nucleici sunt negative și există o dovadă epidemiologică puternică a infecției SARS-CoV-2 testarea unor probe de ser pereche, din faza acută și cea de convalescență, utilizând teste serologice validate, poate susține diagnosticul COVID-1915. În plus, rezultatele testelor serologice pot ajuta la determinarea persoanelor care pot dona plasmă, ce poate servi drept posibil tratament pentru cei cu forme severe de COVID-19.
În prezent, nu este dovedit faptul că persoanele care s-au vindecat de COVID-19 și prezintă anticorpi sunt protejate de o a doua infecție16.
Pregătire pacient – testul nu necesită o pregatire prealabilă17.
Specimen recoltat – sânge venos17.
Recipient de recoltare – vacutainer fără anticoagulant cu/fără gel separator17.
Prelucrare necesară după recoltare – se separă serul prin centrifugare17.
Cauze de respingere a probei – specimen hemolizat, lipemic sau contaminat bacterian17.
Stabilitate probă – serul este stabil 2 zile la temperatura camerei; 2 zile la 2-8ºC; 6 luni la –20ºC17.
Metodă– chemiluminiscență pe bază de microparticule (CMIA)17.
Valori de referință și interpretarea rezultatelor – rezultatele sunt exprimate sub forma unui index.
IgG <1.4 – Negativ
IgG > 1.4 – Pozitiv.
Un rezultat IgG pozitiv indică cel mai probabil o expunere anterioară față de infecția SARS-COV-2, însă nu exclude posibilitatea unei infecții active. În funcție de contextul epidemiologic și simptomatologia pacientului se recomandă testarea RT-PCR în vederea identificarii virusului.
Bibliografie:
- European Centre for Disease Prevention and Control (ECDC). Factsheet for health professionals on Coronaviruses. Factsheet for health professionals on Coronaviruses. Ref Type: Internet Communication. https://www.ecdc.europa.eu/en/factsheet-health-professionals- coronaviruses.
- Tortorici MA, Veesler D. Structural insights into coronavirus entry. Adv Virus Res. 2019;105:93-116.
- Velavan TP, Meyer CG. The COVID-19 Epidemic. Trop Med Int Health. 2020 Mar; 25(3): 278–280.
- Walls AC, Park YJ, Tortorici MA, Wall A, McGuire AT, Veesler D. Structure, Function, and Antigenicity of the SARS-CoV-2 Spike Glycoprotein. Cell. 2020 Apr 16;181(2):281-292.e6.
- Zhang J, Zeng H, Gu J, Li H, Zheng L, Zou Q. Progress and Prospects on Vaccine Development against SARS-CoV-2. Vaccines (Basel). 2020 Mar 29;8(2).
- Guo YR, Cao QD, Hong ZS, Tan YY, Chen SD, Jin HJ, Tan KS, Wang DY, Yan Y. The origin, transmission and clinical therapies on coronavirus disease 2019 (COVID-19) outbreak – an update on the status. Mil Med Res. 2020 Mar 13;7(1):11.
- Wrapp D, Wang N, Corbett KS, Goldsmith JA, Hsieh CL, Abiona O, Graham BS, McLellan JS. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science. 2020 Mar 13;367(6483):1260-1263.
- Kuba K, Imai Y, Penninger JM. Multiple functions of angiotensin-converting enzyme 2 and its relevance in cardiovascular diseases. Circ J. 2013;77(2):301-8.
- Hamming I, Timens W, Bulthuis ML, Lely AT, Navis G, van Goor H. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. J Pathol. 2004 Jun;203(2):631-7.
- Linton NM, Kobayashi T, Yang Y, Hayashi K, Akhmetzhanov AR, Jung SM, Yuan B, Kinoshita R, Nishiura H. Incubation Period and Other Epidemiological Characteristics of 2019 Novel Coronavirus Infections with Right Truncation: A Statistical Analysis of Publicly Available Case Data. J Clin Med. 2020 Feb 17;9(2).
- Comisia de Microbiologie Medicală a Ministerului Sănătății. Comisia de Microbiologie Medicală a Colegiului Medicilor din România.
Infecția cu SARS-CoV-2. Ref Type: Internet Communication
http://www.ms.ro/wp-content/uploads/2020/04/Recomandarea-Comisiilor-de-Microbiologie- Medical%C4%83-a-MS-%C8%99i-CMR- Diagnostic-SARS-CoV-2.pdf - Jose RJ, Manuel A. COVID-19 Cytokine Storm: The Interplay Between Inflammation and Coagulation. Lancet Respir Med. 2020 Apr 27;S2213-2600(20)30216-2.
- Long QX, Liu BZ, Deng HJ, Wu GC, Deng K, Chen YK, Liao P, Qiu JF, Lin Y, Cai XF, Wang DQ, Hu Y, Ren JH, Tang N, Xu YY, Yu LH, Mo Z, Gong F, Zhang XL, Tian WG, Hu L, Zhang XX, Xiang JL, Du HX, Liu HW, Lang CH, Luo XH, Wu SB, Cui XP, Zhou Z, Zhu MM, Wang J, Xue CJ, Li XF, Wang L, Li ZJ, Wang K, Niu CC, Yang QJ, Tang XJ, Zhang Y, Liu XM, Li JJ, Zhang DC, Zhang F, Liu P, Yuan J, Li Q, Hu JL, Chen J, Huang AL. Antibody responses to SARS-CoV-2 in patients with COVID-19. Nat Med. 2020 Apr 29.
- Zhao J, Yuan Q, Wang H, Liu W, Liao X, Su Y, Wang X, Yuan J, Li T, Li J, Qian S, Hong C, Wang F, Liu Y, Wang Z, He Q, Li Z, He B, Zhang T, Fu Y, Ge S, Liu L, Zhang J, Xia N, Zhang Z. Antibody responses to SARS-CoV-2 in patients of novel coronavirus disease 2019. Clin Infect Dis. 2020 Mar 28.
- World Health Organization. Laboratory testing for coronavirus disease (COVID-19) in suspected human cases. Interim guidance 2 March 2020. Ref Type: Internet Communication. https://apps.who.int/iris/bitstream/handle/10665/331329/WHO-COVID-19-laboratory-2020.4- eng.pdf?sequence=1&isAllowed=y.
- World Health Orgnization. „Immunity passports” in the context of COVID-19https://www.who.int/news- room/commentaries/detail/immunity-passports-in-the-context-of-covid-19.
- Laborator. Referintele specifice tehnologiei de lucru utilizate 2020. Ref Type: Catalog
